
《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第四十九条“已注册的第二类、第三类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料”;
服务项目:
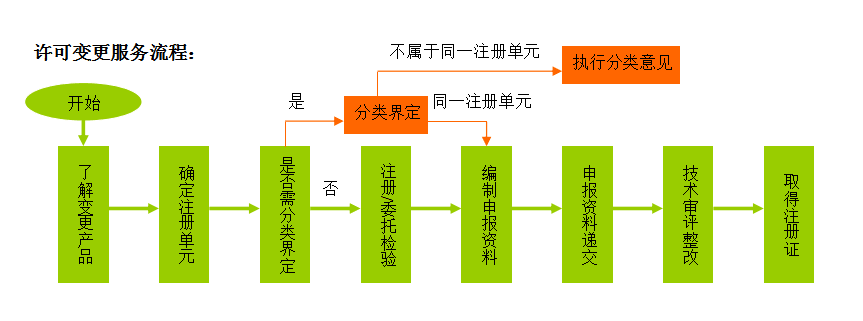
1)确定变更的类型(登记变更、许可变更);
2)(许可变更适用)确定变更产品是否与原获准产品属于同一注册单元;
3)适用时,确定检验典型性型号、协助企业快速取得注册检验报告或符合注册要求的委托检验报告;
4)适用时,注册质量管理体系核查;
5)适用时,临床评价;
6)主导编制变更注册所需的申报资料;
7)整理、审核申报资料,并指导企业递交;
8)技术审评整改(许可变更适用);
9)跟踪、修订(必要时)。
注意事项:
1、登记变更:公司名称、住所、生产地址发生变更;
2、许可变更:产品名称、产品技术要求(如型号增加或减少、性能指标、检验方法等发生实质性变更)
3、注册变更原则上不进行质量管理体系核查;
4、确定注册单元、分类界定适用于产品新增结构组成、新增型号等情形;
5、注册周期视产品种类、检验周期(若需要)、是否具备临床豁免条件以及注册核查(必要时)是否顺利通过等条件限制,根据经验,周期4~12个月不等(不含临床试验,部分产品甚至更长);
Copyright © 2019 杭州医咨佳科技有限公司. All rights reserved